Интернет-портал Российского онкологического общества RUSSCO опубликовал статью заведующего отделением протонной терапии Медицинского института им. Березина Сергея (МИБС) Николая Воробьёва, подготовленную на основе его выступления на Российском онкологическом форуме в ноябре 2019 года.
«Ионизирующее излучение в терапии онкологических заболеваний применяется более 100 лет. На протяжении всего периода существования радиационная онкология постоянно совершенствуется: место рентгеновских и гамма-аппаратов заняли высокоэнергетические линейные ускорители, многолепестковые коллиматоры дают возможность создавать поля сложной формы. Методика модулированной по интенсивности лучевой терапии (IMRT) позволяет существенно снизить лучевую нагрузку на здоровые ткани. Интеграция с компьютерной и магнитно-резонансной томографией помогает улучшить визуализацию, определение объемов и зон облучения. Синхронизация облучения с дыханием пациента позволяет компенсировать смещения мишени и органов риска, тем самым повышая эффективность и безопасность лечения.
Противоопухолевый эффект лучевой терапии в большей степени определяется дозой ионизирующего излучения. В то же время безопасность лечения напрямую зависит от того, насколько удалось снизить лучевую нагрузку на здоровые ткани. Несмотря на технический прогресс, в некоторых случаях методика фотонной терапии не позволяет подвести необходимую туморицидную дозу таким образом, чтобы избежать тяжелых лучевых повреждений.
В отличие от других видов излучений, глубинное распределение дозы для протонов имеет зону медленного подъема с увеличением глубины проникновения, называемую «плато», за которым следует дозовый максимум – «пик Брэгга» (рис.1). Амплитуда этого пика в три-четыре раза превышает дозу на поверхности среды. За пиком Брэгга доза очень быстро падает практически до нуля. Протонная терапия является в настоящее время наиболее мощным средством для получения высокой конформности дозных распределений, позволяя значительно уменьшить лучевую нагрузку на нормальные ткани по сравнению с традиционными методами лучевой терапии пучками фотонов и электронов, даже если мишень вплотную прилежит к критическим структурам организма, и безопасно увеличивая ее на опухоли. Более высокая доза приводит, соответственно, к повышению вероятности гибели раковых клеток [1].
 Рисунок 1. Распределение дозы излучения в зависимости от глубины проникновения.
Рисунок 1. Распределение дозы излучения в зависимости от глубины проникновения.
Впервые предположение о возможности применения протонов в клинической практике высказал Роберт Ратбун Уилсон – американский физик, работавший в области ядерной физики и ускорителей частиц. В 1946 году Уилсон на страницах журнала «Radiology» высказал предположение о том, что протонный пучок может применяться в клинической практике. Однако, хотя это заявление было сделано в 1946 г., первый клинический Центр протонной терапии был открыт лишь спустя 40 лет – Loma Linda University Medical Center. В клинической практике протонная терапия применяется уже более 30 лет.
Технические системы для доставки дозы в протонной терапии постоянно совершенствуются. Несколько лет назад было представлено второе поколение систем для протонного облучения – система сканирования карандашным пучком (Pencil beam scanning). В результате процесс планирования облучения существенно упростился и сегодня занимает столько же времени, сколько и в случае фотонной терапии, также значительно снизилась стоимость оборудования. Быстрое техническое развитие и снижение стоимости систем для протонной терапии повысило доступность методики, что немедленно отразилось на динамике открытия новых центров протонной терапии.
Основные потенциальные клинические преимущества протонной терапии связаны со значительным снижением лучевой нагрузки на здоровые ткани. Это позволяет снизить частоту и выраженность лучевых реакций, снизить риск инвалидизации после лечения и риск развития радиоиндуцированных опухолей. За счет снижения токсичности появляется возможность более широко применять комбинированное химиолучевое лечение, уменьшить токсичность при проведении повторных курсов лучевой терапии в случае рецидива. В некоторых клинических ситуациях, за счет высокой конформности, протонная терапия позволяет повысить эффективность лечения путем увеличения дозы облучения. Это имеет важное значение в случае так называемых «радиорезистентных» опухолей.
Опухоли центральной нервной системы
Особенности расположения опухолей ЦНС существенно ограничивают возможности фотонной лучевой терапии. Доза, необходимая для достижения стойкого контроля над опухолью, зачастую превышает значения, допустимые для органов риска. В подобной ситуации радиотерапевту приходится принимать сложные клинические решения, делая выбор между подведением высокой дозы, способной обеспечить противоопухолевый эффект, и риском повреждения жизненно важных структур. Даже в том случае, если удастся избежать летальных лучевых повреждений, существует высокий риск развития тяжелых нейрокогнитивных расстройств, которые могут быть временными у взрослых, но у детей часто носят необратимый характер. Исследования по сравнению протонной и фотонной лучевой терапии у пациентов с опухолями ЦНС показывают, что применение пучка протонов позволяет значительно снизить нагрузку на здоровые ткани [2], в частности, при проведении краниоспинального облучения. При использовании фотонов все структуры, находящиеся в проекции спинного мозга вплоть до передней грудной (пищевод, щитовидная железа, сердце) и передней брюшной стенки (кишечник, желудок), подвергаются облучению. При этом существенная лучевая нагрузка приходится на скелет и костный мозг (тела позвонков, ребра, грудина, кости таза). Применение протонной терапии позволяет избежать облучения перечисленных выше здоровых тканей, при этом снизив дозу практически до нуля, не доходя до переднего края тел позвонков. В 2013 году были опубликованы результаты исследования по оценке токсичности при проведении протонного и фотонного краниоспинального облучения у 40 взрослых пациентов, медиана наблюдения составила 57 месяцев. В группе протонного облучения было отмечено многократное снижение частоты таких осложнений, как потеря веса (16% при использовании протонов против 64% при фотонах, p=0,004), тошнота и рвота (26% против 71%), эзофагит (5% против 57%, p<0,001) и т.д. [3].
Хордома, хондросаркома
Заболеваниями, при которых протонная терапия применяется наиболее широко, являются хордомы и хондросаркомы основания черепа. Редко когда эти опухоли могут быть удалены хирургически. Применение лучевой терапии также ограниченно из-за расположения опухоли в непосредственной близости от жизненно важных структур – ствола головного мозга, черепных нервов, спинного мозга. Конформная лучевая терапия в дозах 50-60 Гр не обеспечивает требуемого противоопухолевого эффекта, демонстрируя неудовлетворительные показатели безрецидивной выживаемости (менее 25% за 5 лет) [4]. Более высокие дозы могут привести к необратимым повреждениям структур головного мозга и летальному исходу. В тоже время, использование протонного пучка позволяет подводить дозы до 72 Гр и более, при этом демонстрируя низкие показатели токсичности [5], что способствует значительному повышению безрецидивной выживаемости. Так, в исследованиях, проводимых в клинике Paul Scherrer Institute с применением методики модулированной по интенсивности протонной терапии (IMPT), медиана дозы составила 73,5 Гр при хордоме и 68,4 Гр при хондросаркоме. 5-летняя безрецидивная выживаемость составила 81% и 94% для хордом и хондросарком соответственно. Токсичность 3-4 степени на протяжении 5 лет не превысила 6% [6,7].
Поскольку для хордом и хондросарком свойственна высокая частота рецидивирования, пациенты часто нуждаются в проведении повторных курсов облучения. В 2013 году McDonald и соавторы опубликовали результаты проведения повторного курса протонной терапии у 16 пациентов с рецидивом хордомы. У 8 пациентов перед повторным облучением было выполнено частичное удаление опухоли. Двухлетняя безрецидивная выживаемость составила 85%, двухлетняя общая выживаемость – 80%. Нежелательные явления 4 степени были отмечены у 1 пациента, токсичности 5 степени отмечено не было. Полученные результаты свидетельствуют о том, что протонная терапия может эффективно применяться при необходимости проведения повторных курсов облучения по поводу рецидивов, демонстрируя высокие показатели локального контроля и выживаемости в тех ситуациях, когда выбор лечебных методик ограничен [8].
Рак легкого
Стандартом лечения неоперабельных форм местнораспространенного немелкоклеточного рака легкого (НМРЛ) является проведение комбинированной химиолучевой терапии. При этом показатели выживаемости нельзя назвать удовлетворительными, в то время как большинство пациентов страдают от выраженной токсичности, связанной с лечением. При проведении лучевой терапии в дозах 60-64 Гр в комбинации с химиотерапией 5-летняя выживаемость не превышает 15%, медиана выживаемости – 18-20 месяцев, а частота рецидивов достигает 80%. Более чем у 50% пациентов отмечаются серьезные, жизнеугрожающие токсические реакции, такие как пневмонит и эзофагит III и более степени. Исследования по изучению эскалации дозы фотонов до 74 Гр показали, что наряду со снижением риска рецидива существенно возрастает частота летальных осложнений, смертность от которых превышает возможные положительные эффекты при использовании высоких доз излучения [9-11]. Эти результаты свидетельствуют о том, что дальнейшее повышение дозы при использовании фотонов у пациентов с местнораспространенным НМРЛ, по всей видимости, невозможно. В тоже время в исследовании, проведенном в клинике MD Anderson Cancer Center, было продемонстрировано, что применение протонной терапии в дозе 74 Гр позволяет повысить медиану выживаемости (29,4 месяца), снизив частоту рецидивов до 20%, а также значительно снизить частоту и выраженность лучевых реакций (дерматит 11%, эзофагит 11%, пневмонит 2%) [12].
Полученные результаты свидетельствуют в пользу возможной эскалации дозы при помощи протонной терапии с целью увеличения выживаемости, снижения частоты рецидивов, снижения токсичности и возможной интенсификации химиотерапии. В клинике MD Anderson Cancer Center в настоящее время идет набор пациентов в исследование 3 фазы по сравнению эффективности фотонной и протонной лучевой терапии у пациентов с местнораспространенным НМРЛ.
Опухоли головы и шеи
В большом количестве работ по сравнению планов облучения и дозного распределения при использовании протонной и фотонной терапии у пациентов с опухолями головы и шеи отмечено существенное снижение лучевой нагрузки на органы риска в случае применения протонов [13-19].
Подведение туморицидных доз к опухолям, расположенным в области основания черепа, затруднено, а в некоторых случаях невозможно по причине близкого расположения ствола головного мозга. Частота и тяжесть осложнений фотонной лучевой терапии опухолей головы и шеи заставляет снижать дозу, проводить незапланированные перерывы в облучении и заканчивать курс ранее запланированного срока. Применение фотонной 3D-конформной лучевой терапии при опухолях околоносовых пазух приводит к слепоте вследствие ретинопатии или нейропатии зрительного нерва у 24-40% пациентов [20-21]. Работы по сравнительной оценке дозного распределения показали явное преимущество протонной терапии по сравнению с 3D-конформной лучевой терапией и IMRT у пациентов с опухолями полости носа и околоносовых пазух [22]. В исследование Okano и соавт. было включено 13 пациентов с синоназальной карциномой T4b стадии, которым проводилась химиотерапия с последующим курсом протонной лучевой терапии. Полный регресс был отмечен у 85% пациентов, потери зрения или некроза головного мозга не выявлено ни у одного пациента [23]. В другом исследовании оценивались возможности протонной терапии в комбинации с хирургическим и лекарственным лечением у пациентов с опухолевым поражением клиновидных пазух. Показатели двухлетнего локального контроля при дозе 76 Гр составили 86%, 2-летняя безрецидивная выживаемость – 31%, 2-летняя общая выживаемость – 53%. У 6 пациентов отмечен мукозит 3 степени, офтальмопатии 3-4 степени не выявлено [24].
В терапии опухолей носоглотки и ротоглотки предпочтение отдается химиолучевому лечению. Современная фотонная терапия с применением методики IMRT позволяет снизить частоту таких осложнений, как ксеростомия и дисфагия. Однако многими авторами было показано существенное преимущество протонной терапии, заключающееся в лучшем покрытии мишени предписанной дозой излучения и снижении нагрузки на здоровые ткани [25, 26]. Ввиду данного обстоятельства протонная терапия может применяться не только в терапии первичных опухолей носо- и ротоглотки, но и у пациентов с рецидивом после лучевого лечения. В исследовании Lin и соавторов представлен опыт лечения 16 пациентов с рецидивом опухоли носоглотки после курса фотонной лучевой терапии. Облучение протонами проводилось в дозах 60-70 Гр. Показатели двухлетнего локального контроля и безрецидивной выживаемости составили 50% [27]. Из серьезных нежелательных явлений отмечены язва слизистой носоглотки (1 пациент) и остеонекроз (1 пациент). Осложнений со стороны органов центральной нервной системы не отмечено.
Злокачественные опухоли у детей
Среднее число ежегодно регистрируемых злокачественных опухолей у детей увеличилось за последнее десятилетие на 20%. В большинстве случаев лучевая терапия является неотъемлемым компонентом, значительно повышая эффективность лечения. В тоже время, облучение способно оказывать пагубное воздействие, замедляя рост и развитие костей, мышц, органов нервной системы. Также повышается риск развития радиоиндуцированных опухолей. По данным литературы, риск развития вторичных радиоиндуцированных опухолей у пациентов, в детстве получавших лучевую терапию по поводу злокачественных новообразований ЦНС, составляет 10,7% [28]. Вторичные опухоли являются второй по частоте причиной смерти у данной группы пациентов [29]. Также они являются основной причиной гибели тех, кто преодолел 10-летний рубеж с момента лечения [30].
В немногочисленных клинических исследованиях отмечено, что проведение протонной терапии сопровождается существенно меньшим риском развития вторичных радиоиндуцированных опухолей, нежели при использовании фотонов. В одном из ретроспективных исследований оценивался риск развития вторичных опухолей у взрослых, получавших протонную и фотонную лучевую терапию. В каждую группу было набрано по 558 пациентов с медианой наблюдения около 6 лет. Частота развития вторичных опухолей после облучения протонами была ниже и составила 6,9 случаев на 1000 пациентов против 10,3 в группе фотонной терапии [31].
Применение протонной терапии при краниоспинальном облучении также должно способствовать снижению риска развития радиоиндуцированных опухолей. В исследованиях, основанных на математическом моделировании и данных о биологических эффектах ионизирующего излучения, предиктивный риск развития вторичных опухолей оказался в 4-10 раз выше, а предиктивный риск смерти от вторичных опухолей в 2-5 раз выше при использовании фотонной лучевой терапии, чем в случае применения протонов [32]. При оценке рисков, связанных с проведением краниоспинального облучения у пациентов с медуллобластомой, было установлено, что вероятность развития радиоиндуцированных опухолей при использовании протонной терапии существенно ниже, чем при использовании фотонов, и составляет 4% и 30% соответственно [33].
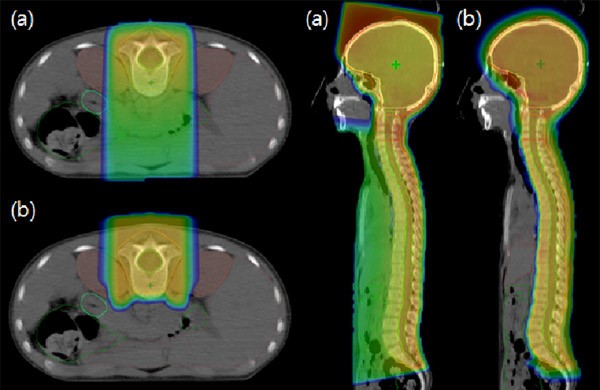
Подобное преимущество протонной терапии является следствием значительного снижения лучевой нагрузки на здоровые ткани (рис.2) и наблюдается не только в случае краниоспинального облучения, но и при лечении ретинобластом, сарком костей и мягких тканей, рабдомиосарком и других злокачественных опухолей. Снижение риска развития вторичных радиоиндуцированных опухолей является важным фактором, свидетельствующим о необходимости применения протонной терапии у пациентов детского возраста.
Рисунок 2. Распределение дозы при фотонной (a) и протонной (b) терапии.
Экономические преимущества
В ряде исследований было отмечено, что снижение риска развития постлучевых осложнений при использовании протонной терапии также приводит к значительному снижению финансовой нагрузки на систему здравоохранения за счет уменьшения расходов на лечение осложнений. Значительная экономия средств достигается путем снижения частоты развития таких побочных эффектов, как потеря слуха, потеря зрения, кардиотоксичность, развитие радиоиндуцированных опухолей. Экономические расчеты, выполненные в условиях Шведской системы здравоохранения, показали более чем двукратное снижение расходов на лечение постлучевых осложнений в случае применения у детей протонной терапии, в отличие от фотонного облучения (см. таблицу). Снижение дозы на гипоталамус на 10 Гр при использовании протонов значительно снижает риск развития гормональной недостаточности и, следовательно, позволяет сократить расходы на проведение последующей заместительной гормонотерапии.
Таблица. Стоимость фотонной и протонной лучевой терапии при медуллобластоме [34].
| Фотонная терапия | Протонная терапия | Различие | |
| Лучевая терапия | 5 622$ | 13 552$ | ×2,5 |
| Лечение осложнений | 44 905$ | 5 613$ | ×8 |
| Всего | 50 527$ | 19 165$ | ×2,6 |
В 2016 году был опубликован обзор исследований, посвященных оценке стоимости применения протонной терапии в зависимости от патологии и возраста пациентов [35]. Было установлено, что с точки зрения финансовой нагрузки на систему здравоохранения применение протонной терапии может быть экономически эффективным при местнораспространенных формах НМРЛ, при терапии рака левой молочной железы, опухолей головы и шеи, у пациентов детского возраста.
Любую, даже самую эффективную методику лечения очень легко дискредитировать. Особенно в тот период, когда идет определение показаний для применения и места данной методики среди других видов терапии. Одним из ключевых факторов, определяющих эффективность метода, является правильный отбор пациентов. Если активно набирать в группу протонной терапии пациентов с метастатическим поражением головного мозга или проводить лечение только детям, но с глиомами ствола, то мы не увидим преимуществ протонной терапии. Чуда на произойдет, пациенты с изначально плохим прогнозом не станут жить дольше за счет применения протонов.
В разных Центрах проблему отбора пациентов для протонной терапии решают по-разному. Где-то исходят из принципов экономической целесообразности, в других клиниках используют специальные прогностические модели, которые помогают оценить риски развития нежелательных явлений при использовании протонов и фотонов у пациента с тем или иным заболеванием. Исходя из физических особенностей протонов, можно выделить несколько групп пациентов, для которых применение протонной терапии является наиболее предпочтительным:
- Пациенты, у которых в силу особенностей расположения опухоли невозможно подвести требуемую противоопухолевую дозу, не вызвав тяжелого лучевого повреждения здоровых тканей.
- Пациенты из группы благоприятного прогноза, с высокой ожидаемой продолжительностью жизни и высоким риском дожить до вторичных радиоиндуцированных опухолей или поздней лучевой токсичности.
- Пациенты, нуждающиеся в проведении повторного курса лучевой терапии по поводу рецидива.
В 2017 году Американское Общество Радиационных Онкологов (ASTRO) опубликовало специальный документ для страховых компаний, согласно которому покрытие расходов при использовании протонной терапии рекомендовано для пациентов с опухолями органа зрения, с доброкачественными и злокачественными опухолями спинного мозга, больным с опухолями основания черепа (в т.ч. хордомами), с гепатоцеллюлярным раком, всем пациентам детского возраста и пациентам, нуждающимся в проведении повторного курса лучевой терапии по поводу рецидива [36].
Помимо перечисленных в данной статье злокачественных опухолей, протонная терапия также может иметь потенциальное преимущество при лечении рака прямой кишки, желудка, поджелудочной железы, опухолей костей и мягких тканей (за счет снижения лучевой нагрузки на кишечник, мочевой пузырь, легкие, спинной мозг). Уменьшение патологического воздействия на костный мозг и снижение гематологической токсичности может способствовать более активному применению химиотерапии конкурентно с протонной лучевой терапией.
В настоящее время идет активное накопление опыта клинического применения протонной терапии. Ежегодно стартуют новые проспективные исследования, посвященные изучению роли протонов в лечении онкологических заболеваний. Полученные результаты должны помочь определить группы пациентов, для которых протонная терапия будет иметь решающее значение в улучшении контроля над заболеванием, повышении общей выживаемости и сохранении качества жизни».
Ссылки:
- Климанов В.А. Радиобиологическое и дозиметрическое планирование лучевой и радионуклидной терапии. Часть 2. Лучевая терапия пучками протонов, ионов, нейтронов и пучками с модулированной интенсивностью, стереотаксис, брахитерапия, радионуклидная терапия, оптимизация, гарантия качества. Учебное пособие. М.: НИЯУ МИФИ. 2011.
- cerncourier.com/a/the-changing-landscape-of-cancer-therapy/.
- Brown AP, et al. Proton beam craniospinal irradiation reduces acute toxicity for adults with medulloblastoma. Int J Radiat Oncol Biol Phys. 2013 Jun 1; 86(2): 277-84. doi: 10.1016/j.ijrobp.2013.01.014.
- Zorlu F, Gurkaynak M, Yildiz F, et al. Conventional external radiotherapy in the management of clivus chordomas with overt residual disease. Neurol Sci. 2000. Vol.21, P.203-207.
- Santoni R, Liebsch N, Finkelstein DM, et al. Temporal lobe (TL) damage following surgery and high-dose photon and proton irradiation in 96 patients affected by chordomas and chondrosarcomas of the base of the skull. Int J Radiat Oncol Biol Phys. 1998. Vol.41, P.59-68.
- Ares C, Hug EB, Lomax AJ, et al. Effectiveness and safety of spot scanning proton radiation therapy for chordomas and chondrosarcomas of the skull base: First long-term report. Int J Radiat Oncol Biol Phys. 2009. Vol.75, P.1111-1118.
- Rombi B, Ares C, Hug EB, et al. Spot-scanning proton radiation therapy for pediatric chordoma and chondrosarcoma: Clinical outcome of 26 patients treated at Paul Scherrer Institute. Int J Radiat Oncol. 2013. Vol.86, P.578-584.
- McDonald MW, Linton OR, Shah MV. Proton therapy for reirradiation of progressive or recurrent chordoma. Int J Radiat Oncol Biol Phys. 2013. Vol.87, P.1107-1114.
- Schild SE, McGinnis WL, Graham D, et al. Results of a Phase I trial of concurrent chemotherapy and escalating doses of radiation for unresectable non-small-cell lung cancer. Int J Radiat Oncol Biol Phys. 2006. Vol.65(4), P.1106-1111.
- Bradley JD, Paulus R, Komaki R, et al. A randomized phase III comparison of standard-dose (60 Gy) versus high-dose (74 Gy) conformal chemoradiotherapy +/− cetuximab for stage IIIA/IIIB nonsmall cell lung cancer: preliminary findings on radiation dose in RTOG 0617 [abstract]. Miami Beach, FL: 53rd Annual Meeting of the American Society for Radiation Oncology. 2011.
- Cox JD. Are the results of RTOG 0617 mysterious? Int J Radiat Oncol Biol Phys. 2012. Vol.82(3), P.1042-1044.
- Sejpal S, Komaki R, Tsao A, et al. Early Findings on Toxicity of Proton Beam Therapy with Concurrent Chemotherapy in Nonsmall Cell Lung Cancer. Cancer. 2011. Vol.117, P.3004-3013.
- Van de Water TA, Lomax AJ, Bijl HP, et al. Potential benefits of scanned intensity-modulated proton therapy versus advanced photon therapy with regard to sparing of the salivary glands in oropharyngeal cancer. Int J Radiat Oncol Biol Phys. 2011. Vol.79, P.1216-1224.
- Steneker M, Lomax A, Schneider U. Intensity modulated photon and proton therapy for the treatment of head and neck tumors. Radiother Oncol. 2006. Vol.80, P.263-267.
- Miralbell R, Crowell C, Suit HD. Potential improvement of three dimension treatment planning and proton therapy in the outcome of maxillary sinus cancer. Int J Radiat Oncol Biol Phys. 1992. Vol.22, P.305-310.
- Miralbell R, Lomax A, Cella L, et al. Potential reduction of the incidence of radiation-induced second cancers by using proton beams in the treatment of pediatric tumors. Int J Radiat Oncol Biol Phys. 2002. Vol.54, P.824-829.
- Van de Water TA, Lomax AJ, Bijl HP, et al. Using a reduced spot size for intensity-modulated proton therapy potentially improves salivary gland-sparing in oropharyngeal cancer. Int J Radiat Oncol Biol Phys. 2012. Vol.82, P.e313-e319.
- Yoon M, Ahn SH, Kim J, et al. Radiation-induced cancers from modern radiotherapy techniques: Intensity-modulated radiotherapy proton therapy. Int J Radiat Oncol Biol Phys. 2010. Vol.77, P.1477-1485.
- Weber DC, Chan AW, Lessell S, et al. Visual outcome of accelerated fractionated radiation for advanced sinonasal malignancies employing photons/protons. Radiother Oncol. 2006. Vol.81, P.243-249.
- Takeda A, Shigematsu N, Suzuki S, et al. Late retinal complications of radiation therapy for nasal and paranasal malignancies: Relationship between irradiated-dose area and severity. Int J Radiat Oncol Biol Phys. 1999. Vol.44, P.599-605.
- Katz TS, Mendenhall WM, Morris CG, et al. Malignant tumors of the nasal cavity and paranasal sinuses. Head Neck. 2002. Vol.24, P.821-829.
- Mock U, Georg D, Bogner J, et al. Treatment planning comparison of conventional, 3D conformal, and intensity-modulated photon (IMRT) and proton therapy for paranasal sinus carcinoma. Int J Radiat Oncol Biol Phys. 2004. Vol.58, P.147-154.
- Okano S, Tahara M, Zenda S, et al. Induction chemotherapy with docetaxel, cisplatin and S-1 followed by proton beam therapy concurrent with cisplatin in patients with T4b nasal and sinonasal malignancies. Jpn J Clin Oncol. 2012. Vol.42, P.691-696.
- Truong MT, Kamat UR, Liebsch NJ, et al. Proton radiation therapy for primary sphenoid sinus malignancies: Treatment outcome and prognostic factors. Head Neck. 2009. Vol.31, P.1297-1308.
- Van der Laan HP, van de Water TA, van Herpt HE, et al. The potential of intensity-modulated proton radiotherapy to reduce swallowing dysfunction in the treatment of head and neck cancer: A planning comparative study. Acta Oncol. 2013. Vol.52, P.561-569.
- Van de Water TA, Lomax AJ, Bijl HP, et al. Potential benefits of scanned intensity-modulated proton therapy versus advanced photon therapy with regard to sparing of the salivary glands in oropharyngeal cancer. Int J Radiat Oncol Biol Phys. 2011. Vol.79, P.1216-1224.
- Lin R, Slater JD, Yonemoto LT, et al. Nasopharyngeal carcinoma: Repeat treatment with conformal proton therapyddose-volume histogram analysis. Radiology. 1999. Vol.213, P.489-494.
- Armstrong GT. Long-term survivors of childhood central nervous system malignancies: the experience of the Childhood Cancer Survivor Study. Eur. J. Paediatr. Neurol. 2010. Vol.14, P.298-303.
- Mertens AC, et al. Cause-specific late mortality among 5-year survivors of childhood cancer: the Childhood Cancer Survivor Study. J. Natl Cancer Inst. 2008. Vol.100, P.1368-1379.
- Morris EB, et al. Survival and late mortality in longterm survivors of pediatric CNS tumors J. Clin. Oncol. 2007. Vol.25, P.1532-1538.
- Chung CS, et al. Incidence of second malignancies among patients treated with proton versus photon radiation. Int. J. Radiat. Oncol. Biol. Phys. 2013. Vol.87, P.46-52.
- Zhang R, et al. A comparative study on the risks of radiogenic second cancers and cardiac mortality in a set of pediatric medulloblastoma patients treated with photon or proton craniospinal irradiation. Radiother. Oncol. 2014. Vol.113, P.84-88.
- Mu X, Bjork-Eriksson T, Nill S, et al. Does electron and proton therapy reduce the risk of radiation induced cancer after spinal irradiation for childhood medulloblastoma? А comparative treatment planning study. Acta Oncol. 2005. Vol.44(6), P.554-562.
- Lundkvist J, Ekman M, Ericsson SR, Jonsson B, Glimelius B. Proton therapy of cancer: potential clinical advantages and cost-effectiveness. Acta Oncol. 2005. Vol.44, P.850-861.
- Verma V, Mishra MV, Mehta MP. A systematic review of the cost and cost-effectiveness studies of proton radiotherapy. Cancer. 2016 May 15; 122(10): 1483-501.
- astro.org/…/ASTROPBTModelPolicy.pdf
- Glimelius B, Montelius A. Proton beam therapy – Do we need the randomized trials and can we do them? Radiother Oncol. 2007. 83: 105-109.
- Goitein M, Cox JD. Should randomized clinical trials be required for proton radiotherapy? J Clin Oncol. 2008. 26: 175-176.
- Bentzen SM. Randomized controlled trials in health technology assessment: Overkill or overdue? Radiother Oncol. 2008. 86: 142-147.
- Higgins KA, et al. National Cancer Database Analysis of Proton Versus Photon Radiation Therapy in Non-Small Cell Lung Cancer. Int Journal Radiat Oncol Biol Phys. 2017. 97(1): 128-137.
- Sejpal S, et al. Early findings on toxicity of proton beam therapy with concurrent chemotherapy for nonsmall cell lung cancer. Cancer. 2011. 117(13): 3004-13.
- Liao Z, et al. Bayesian Adaptive Randomization Trial of Passive Scattering Proton Therapy and Intensity-Modulated Photon Radiotherapy for Locally Advanced Non-Small-Cell Lung Cancer. Journal of Clinical Oncology. 2018. 36(18): 1813-1822.
- Wang J, et al. Predictors of postoperative complications after trimodality therapy for esophageal cancer. Int J Radiat Oncol Biol Phys. 2013 Aug 1; 86(5): 885-91.
- Xi M, et al. Comparative Outcomes After Definitive Chemoradiotherapy Using Proton Beam Therapy Versus Intensity Modulated Radiation Therapy for Esophageal Cancer: A Retrospective, Single-Institutional Analysis. Int J Radiat Oncol Biol Phys. 2017 Nov 1; 99(3): 667-676.
- Lin SH, et al. Results of a Phase II Randomized Trial of Proton Beam Therapy vs Intensity Modulated Radiation Therapy in Esophageal Cancer. ASTRO 2019.
- Sheets NC, et al. Intensity-modulated radiation therapy, proton therapy, or conformal radiation therapy and morbidity and disease control in localized prostate cancer. JAMA. 2012 Apr 18; 307(15): 1611-20.
- Dinh TT, et al. Rectal Hydrogel Spacer Improves Late Gastrointestinal Toxicity Compared To Rectal Balloon Immobilization After Proton Beam Radiotherapy For Localized Prostate Cancer, In Press.
- Hamstra DA, et al. Continued Benefit to Rectal Separation for Prostate Radiation Therapy: Final Results of a Phase III Trial. Int J Radiation Oncol Biol Phys. 2017. 97(5): 976-985.
- Wo JH, et al. A Pilot Feasibility Study of Definitive Concurrent Chemoradiation with Pencil Beam Scanning Proton Beam in Combination with 5 Fluorouracil and Mitomycin C for Carcinoma of the Anal Canal. Journal of Clinical Oncology. 2018. 36(4): 733-733.
- Haas-Kogan D, et al. National Cancer Institute Workshop on Proton Therapy for Children: Considerations Regarding Brainstem Injury. Int J Radiat Oncol Biol Phys. 2018 May 1; 101(1): 152-168.
- Feghali, et al. Prospective Phase II Randomized Trial Comparing Proton Therapy vs Photon IMRT for newly Diagnosed GBM: Secondary Analysis Comparison of Progression Free survival between RANO vs. Clinical and Radiological Assessment. ASTRO 2019.
- Corkum MT, et al. Online advertising and marketing claims by providers of proton beam therapy: are they guideline based? ASCO 2019 poster.
- Beyreuther E, et al. Feasibility of proton FLASH effect tested by zebrafish embryo irradiation. Radiother Oncol. 2019 Oct; 139: 46-50.
- Sheng K, et al. Evolution of Ipsilateral Head and Neck Radiotherapy. Current Cancer Therapy Reviewsю 2014; 10(4).