Авторы: Mauro Loi, Joost J Nuyttens, Isacco Desideri, Daniela Greto, Lorenzo Livi
Отделение лучевой терапии, Университет Флоренции, Италия; Отделение радиотерапии, Онкологический центр Эразмус, Роттердам, Нидерланды
Краткое содержание:
Костные метастазы часто являются основной причиной возникновения осложнений у онкологических больных. Стереотаксическая лучевая терапия тела (СЛТТ) – это зарекомендовавший себя метод лечения, используемый для установления местного контроля над болезнью и для облегчения боли, причиняемой костными метастазами. Она все чаще используется в качестве дооперационного, послеоперационного консолидирующего лечения или в качестве терапии спасения после первоначальной радиотерапии. Однако разнородность режимов облучения, описанных в научной литературе, может стать серьезным препятствием для определения роли СЛТТ в качестве стандартной медицинской помощи. Не существует единого мнения касательно преимуществ однофракционной терапии по сравнению с многофракционной СЛТТ при лечении костных метастазов. Преимущества однофракционной СЛТТ включают меньшую общую продолжительность курса лечения, отсутствие фактора неопределенности между фракциями, лучшую комплаентность пациентов, теоретически более высокую эффективность и меньшие затраты. Однако, в связи с появлением статей о тяжелых поздних токсичностях, таких как компрессионный перелом позвоночника, рекомендуется быть очень осторожным при выборе методов лечения. Целью данной работы является анализ различных схем фракционирования доз облучения и показаний для лечения костных метастазов с использованием СЛТТ.
Вводная часть
У онкологических больных метастатическое поражение костей встречается довольно часто. Оно имеется примерно у 15-70% пациентов с раком на поздних стадиях в зависимости от локализации первичной опухоли, и только в Соединенных Штатах каждый год фиксируется около 100 000 новых случаев. Наличие устойчивых болей отмечается у 70% пациентов с костными метастазами. Неконтролируемые костные метастазы являются одной из главных причин возникновения осложнений у онкологических больных, приводящих к патологическим переломам, гиперкальцемии, и неврологическим расстройствам. Осложнения, вызванные костными метастазами, в совокупности определяются как события, связанные со скелетной системой, и представляют собой серьезную угрозу для состояния здоровья и качества жизни онкологических пациентов. Кроме того, социально-экономическое бремя этого заболевания также вызывает большую озабоченность, поскольку ежемесячная стоимость лечения выросла с € 190 у бессимптомных пациентов, принимавших участие в проспективном многоцентровом исследовании, до € 4672 у пациентов с событиями, связанными со скелетной системой. Традиционная лучевая терапия, доставляющая дозы облучения в диапазоне от 8 Гр за 1 фракцию до 30 Гр за 10 фракций, является основным способом лечения костных метастазов, обеспечивая быстрое смягчение симптомов и доброкачественный профиль токсичности, а использование других хирургических или медицинских методов лечения не исключает использование радиотерапии. Однако долгосрочные результаты часто разочаровывают, показывая полное купирование боли только у 24% больных без явного преимущества однофракционной терапии над другими схемами облучения. Отсутствие контроля над симптомами также часто приводит к повторному лечению, в том числе и после однофракционной радиотерапии, хотя никаких особых преимуществ в методах лечения не было отмечено у более чем 40% пациентов, независимо от первоначального ответа на лечение или от режима облучения. Возможность получения устойчивой сопротивляемости к болезни и контроля над симптомами вызывает особый интерес у специалистов в связи с постоянным ростом сроков выживаемости среди больных раком, в первую очередь в таких подгруппах, таких как олигометастатические пациенты, которые имеют более длительные сроки выживаемости по сравнению с полиметастатическими пациентами. Стереотаксическая лучевая терапии тела (СЛТТ), определяется как доставка высокой дозы облучения за одну фракцию в течение короткого курса лечения, и позволяет доставлять потенциально аблятивные дозы радиации в центр мишеней — метастазов с крутым градиентом дозы, что сводит к минимуму воздействие излучения на соседние критические органы. По этим причинам СЛТТ стала общепризнанным методом лечения костных метастазов в качестве первичной терапии, включая случаи метастатического поражения позвоночника, а также послеоперационной консолидационной или спасительной терапии после первоначальной радиотерапии. По сравнению с традиционной лучевой терапией, паллиативное облучение СЛТТ высокими биологически эффективными дозами (БЭД) может привести к улучшению контроля над опухолью и быстрым облегчением симптомов. Результаты исследований IRON-1 говорят в пользу однофракционной СЛТТ терапии дозой 24 Гр по сравнению с трехмерной лучевой терапией (3DRT) дозой 30 Гр за 10 фракций в плане облегчения боли. Для оценки превосходства СЛТТ над традиционной лучевой терапией с точки зрения контроля над опухолью, облегчения симптомов и качества жизни пациентов в настоящее время ведутся рандомизированные исследования III фазы. Примечательно, что использование СЛТТ может представлять особый интерес для лечения олигометастатических пациентов, которые также могут иметь лучшую выживаемость без системной терапии благодаря снижению бремени болезни, благодаря использованию местной аблативной терапии. Лабораторный анализ образцов прооперированной опухоли после СЛТТ доказал отсутствие остаточных жизнеспособных тканей опухоли в более чем 80% случаев, что подтверждает достоверность инструментального анализа и демонстрирует то, что СЛТТ в большинстве случаев является абляционной процедурой. Однако, разнородность схем облучения, описанных в научной литературе, может стать серьезным препятствием для определения роли СЛТТ в качестве стандартной медицинской помощи. На данный момент не существует единого мнения касательно преимуществ использования однофракционной терапии в сравнении с многофракционной СЛТТ при лечении костных метастазов. Преимущества однофракционной СЛТТ включают меньшую общую продолжительность курса лечения, отсутствие фактора неопределенности между фракциями, лучшую комплаентность пациентов, теоретически более высокую эффективность и меньшие затраты. Однако, в то время как многолетние серии исследований в целом демонстрируют многообещающие результаты однофракционной терапии, сообщения о случаях отдаленной тяжелой токсичности (в частности, при лечении позвоночника) привели к более широкому использованию многофракционных схем лечения с целью снижения токсичности. Неясно, может ли фракционирование влиять на клинические результаты лечения пациентов, получавших СЛТТ, в плане паллиативного смягчения симптомов, длительности контроля над болевыми ощущениями, необходимости повторного курса лучевой терапии, а также риска ятрогенной токсичности. Это имеет большое значение для клинической практики, так как правильный выбор режима лечения должен быть оправдан и должен зависеть от клинических проявлений у пациентов, являющихся кандидатами на СЛТТ. Целью данной работы является анализ различных схем фракционирования доз облучения и показаний для лечения костных метастазов с использованием СЛТТ. 7 марта 2019 года был выполнен поиск на портале PubMed, используя термины <<< (стереотаксическая или СЛТТ или радиохирургия) и (метастазы в кости или позвоночник или позвоночника или позвоночные или костные метастазы) и >>, в результате поиска было получено 767 записей. Отбор записей на предмет соответствия был проведен двумя независимыми командами исследований для того, чтобы идентифицировать необходимые документы. Для целей настоящего исследования из полученных результатов поиска были исключены обзоры, исследования по планированию доз и истории болезни, и также были удалены статьи, несвязанные с темой исследования (в том числе о повторном облучении после конформной / стереотаксической лучевой терапии и послеоперационной консолидационной радиотерапии, а также были удалены различные локализации, включая внекостные. В случае разногласий, окончательное решение формулировалось третьим автором исследования. Полнотекстовые документы, признанные как соответствующие теме исследования и включенные в анализ, приведены в таблицах 1 и 2.
Таблица 1. Избранные исследования по использованию стереотаксической лучевой терапии для лечения костных метастазов, данные по показателям эффективности.
Таблица 2 Избранные исследования по применению стереотаксической лучевой терапии костных метастазов, данные о компрессионных переломах позвоночника и прогностические факторы
Метастазы в позвоночник
Общие положения
Осевой скелет человека является наиболее распространенным местом вторичных опухолей, и на него приходится около 40% локализаций метастазов в позвоночник. Применение СЛТТ для лечения болезненных спинальных метастазов было опробовано еще в середине 1990-х годов. СЛТТ первоначально задумывалась как одиночный импульс дозой 8 Гр на общий объем опухоли после обычной паллиативной лучевой терапии в целях доставки максимальной дозы в опухоль и с соблюдением ограничений для дозы облучения на позвоночник. Это привело к снижению уровня боли без дополнительных острых токсичностей. Эффективность дооперационной СЛТТ для лечения ранее необлученных патологических новообразований была подтверждена авторами исследований Garg et al. Возможность повышения дозы до 16 Гр была подтверждена в ходе исследований II фазы RTOG 0631. Нужно отметить, что точное облучение опухоли не приводило к большей частоте рецидивов в близлежащих областях: так как одним из основных аргументов против использования СЛТТ было то, что соседние уровни позвоночника остаются необлученными. Этот вывод подтвердил эффективность лечения только пораженного участка позвоночника, как ранее сообщали Ryu et al, которые зафиксировали частоту возникновения рецидивов <5% в ближайших смежных позвонках. Это было подтверждено и Leeman et al, которые зафиксировали поражение соседних позвонков в 2% случаев. Последующее проспективное исследование, в котором участвовала большая когорта пациентов, исследовало клинические результаты однофракционной СЛТТ (20-25 Гр) 500 спинальных метастазов смешанных первичных опухолей, подтвердив отличный контроль над болью в симптоматических опухолях (290/336, 86%) и смягчение неврологических нарушений (27/32, 84%) при среднем сроке наблюдения 21 (3-53) месяц. Современная серия СЛТТ демонстрирует многообещающий уровень 1-летнего локального контроля у 60-95% пациентов и 1-летнего контроля над симптомами у 43- 90% пациентов (таблица 1 и рисунок 1). Независимо от использования однофракционной или многофракционной СЛТТ, была определена зависимость доза-реакция: улучшенный локальный контроль был отмечен в метастазах саркомы после облучения БЭД> 48 Гр, тогда как в другой работе о спинальных метастазах разных гистологий, уровень локальной неэффективности лечения не превышал 2% у пациентов, получающих дозу минимум 23.56 Гр в эквивалентной дозе (EQD2) на 95% общего объема опухоли. Тоже касается и облегчения симптомов: в исследовании Jahaveri et al пациенты с почечно-клеточной карциномой, прошедшие лечение фракционированной радиотерапией с БЭД> 85 Гр, имели более быстрый и длительный контроль над болью, чем пациенты, получившие меньшие суммарные дозы.
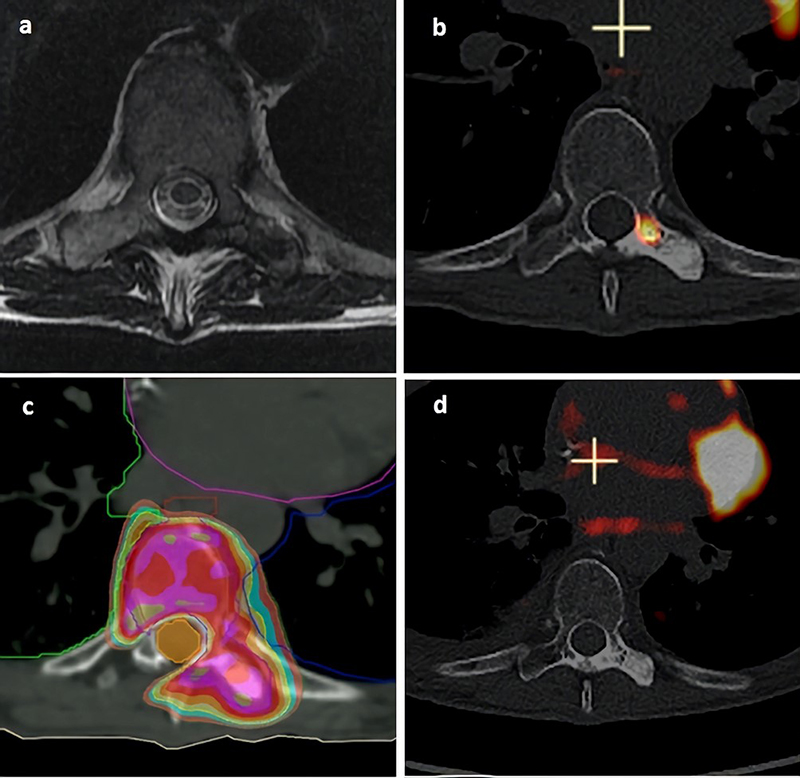
Рисунок 1. 68-летняя женщина, страдающая от метастатического рака молочной железы, была направлена на СЛТТ болезненного метастаза левой поперечной ножки 8-го грудного позвонка.
Комментарии к снимкам: (А) Снимок МРТ до проведения СЛТТ. (В) Снимок 18FDG-PET до проведения СЛТТ. (С) Планирование лечения до облучения одной фракцией дозой 18 Гр 80% линии изодозы (цвета темно-оранжевый, светло-голубой, желтый, золотой, фиолетовый, красный и оливковый соответствуют соответственно 14, 15, 16, 17, 18, 19, 20 и 21 Гр) позволило добиться конформного распределения дозы, не затрагивающего спинномозговой канал (светло-оранжевый цвет). (D) Снимок 18FDG-PET через 6 месяцев после СЛТТ показывает стабильную минерализацию области облучения и полный метаболический ответ. Острая токсичность включала G2 дисфагию из-за близости пищевода. Не было отмечено случаев поздней токсичности в течение 1 года, в то же время был получен полный контроль над болью.
Однофракционная или многофракционная СЛТТ?
Хотя увеличение доз облучения могло и оказаться полезным, особое внимание уделялось достижению клинически активных уровней доз с соблюдением ограничения воздействия на здоровые ткани. В частности, применение однофракционной СЛТТ, зарекомендовавшего себя метода лечения, было поставлено под сомнение в связи с появлением информации о компрессионном переломе позвоночника в 39% случаев после доставки однократной дозы 24 Гр или выше, и таким образом, предпочтение сместилось в сторону схем многократного фракционирования в попытке уменьшить количество серьезных неблагоприятных событий при сохранении эффективной суммарной дозы. Однако, оптимальная схема фракционирования, позволяющая добиться приемлемого компромисса между эффективностью и безопасностью, продолжает оставаться предметом споров. Было сделано предположение, что радиобиологические эффекты однократной дозы> 15-20 Гр могут включать повышенную биологическую активность по сравнению с меньшей фракционированной дозой, в том числе повреждение эндотелия, связанное с сфингомиелинными / церамидными путями. Лабораторное исследование удаленных метастазов, облученных перед операцией однофракционной дозой 18 Гр, показало наступление значительного некроза опухоли и уменьшения плотности сосудов в течение 24 часов. Это наблюдение подтверждает гипотезу о том, что более выраженное противоопухолевое действие облучения, а также остерадионекроз, могут произойти после однофракционной СЛТТ вслед за микрососудистым повреждением: отсюда можно сделать вывод, что теоретически более высокая эффективность однофракционной СЛТТ и повышенный риск местных побочных эффектов могут быть двумя сторонами одной медали. Однако в клинической практике нет никаких формальных доказательств этому.
С одной стороны, несколько работ, сравнивающих различные схемы дозировки СЛТТ, показывают значительно более высокий уровень контроля над болью и локального контроля над опухолью у однофракционной СЛТТ по сравнению с многофракционной терапией. Тем не менее, интенсивность доз в схемах фракционирования, используемых в этих исследованиях, не может быть такой высокой, как в однофракционной СЛТТ. Например, в исследовании Ghia et al доза 24 Гр одной фракцией оказалось эффективнее 27 Гр за 3 фракции и 30 Гр за 5 фракций с точки зрения локального контроля над спинальными метастазами почечно-клеточной карциномы, однако, используя альфа / бета соотношение 10, это соответствует совершенно другим биологически эффективным дозам 81.6, 51.3 и 48 Гр соответственно. Следовательно, использование однофракционного облучения было связанно с почти 1.5-2-кратным увеличением биологически эффективной дозы (БЭД), по сравнению с многофракционными схемами облучения, что, возможно, объясняет лучшие результаты в этой группе больных. Следует отметить, что последующее наблюдение в течение 5 лет не выявило более высокую токсичность у пациентов, получавших однофракционную СЛТТ, а общая частота случаев компрессионного перелома позвоночника составила 14%. Интересно отметить, что в работе Heron et al средняя однократная доза 16 Гр (что соответствует БЭД = 41.6 Гр), несмотря на более быстрое облегчение боли, показала худший локальный контроль по сравнению с дозами, в среднем составлявшими 23.8-25 Гр за 4 -5 фракций (что соответствует БЭД 37.1-38.4). В исследованиях Bishop et al с участием большой когорты пациентов локальный рецидив коррелировал с недостаточным охватом опухоли независимо от схемы фракционирования, предполагавшей облучение общего объема опухоли минимальной дозой выше 14 Гр за 1 фракцию и 21 Гр за 3 фракции. Необходимо все таки отметить, что среди вышеупомянутых исследований лучший контроль над опухолью для однофракционной схемы был отмечен в группах пациентов, имевших радиорезистентные первичные опухоли, такие как саркомы и почечно-клеточные карциномы, тогда как доза 14-18 Гр однократной фракцией была недостаточной для преодоления радиорезистентности у гепатоцеллюлярной карциномы по сравнению с другими гистотипами: таким образом, как бы это не было заманчиво, гипотезу о лучшей эффективности однофракционной СЛТТ в зависимости от гистологии опухоли нельзя исключать окончательно.
С другой стороны, доза за одну фракцию на тело позвонка коррелирует с компрессионным переломом позвоночника и, что самое интересное, использование однофракционных доз ≥20 Гр ставится под сомнение и рассматривается в качестве главного фактора риска. Частота случаев компрессионного перелома позвоночника (de novo или прогрессирование существующего перелома) сильно варьирует у разных авторов (таблица 2), и они могут происходить в течение 5 лет после лечения. Работа Sahgal et al, называющая дозу облучения за одну фракцию ≥20 и ≥24 как независимый фактор риска компрессионного перелома позвоночника (HR: 4.9 и 5.2, соответственно), рекомендует проявлять осторожность при использовании однофракционной СЛТТ для лечения спинальных метастазов. Поскольку схемы СЛТТ не указывают эквивалентные дозы, неясно, насколько жестко зависит компрессионный перелом позвоночника от однофракционной дозы в отличие от суммарной дозы: Jawad et al сообщают о более высокой частоте случаев компрессионного перелома позвоночника для 2 Гр — эквивалентной дозы (EQD2)> 38.4 Гр (что соответствует примерно 17, 24 и 29 Гр за 1, 3 и 5 фракций, соответственно) независимо от использования одной или нескольких фракций. Однако, чтобы избежать чрезмерного упрощения, следует отметить, что компрессионный перелом позвоночника является сложным процессом, который может возникнуть в результате наличия определенного количества предрасполагающих факторов, помимо схемы облучения. Литические метастазы показывают более высокий риск компрессионного перелома позвоночника, и для предсказания риска перелома был протестирован автоматический расчет объема литического компонента. У пациентов, имеющих компрессионный перелом позвоночника, также часто встречаются смещения позвонков и старые переломы позвоночника. Все эти факторы, взятые вместе, могут приводить к общей механической нестабильности позвоночника, что является предметом особого беспокойства, так как это было связано как с началом компрессионного перелома позвоночника и локальной неудачи лечения. Интересно, что Kelley et al сообщили о лучшем локальном контроле после однофракционной СЛТТ со средней дозой 16 (16-20) Гр по сравнению с гипофрационной СЛТТ. При отборе потенциальных кандидатов на СЛТТ необходимо учитывать механическую нестабильность позвоночника во избежание рисков осложнений. После всестороннего анализа согласительной комиссии была выработана шкала нестабильности позвоночника (Spinal Instability Neoplastic Score), включающая как клинические, так и рентгенологические данные: анализ подгруппы пациентов из проспективного этапа испытаний II фазы подтвердил эффективность этой шкалы в прогнозировании случаев компрессионного перелома позвоночника после СЛТТ позвоночника, показывая 2 годичную частоту переломов 31.6% у пациентов с высокими (7-12) баллами по сравнению с частотой 7.1% у пациентов с низкими (<7) баллами по этой шкале. Тщательная оценка нестабильности позвоночника может влиять на выбор между профилактической хирургической стабилизацией или аугментацией цементом после СЛТТ – процедурами, которые успешно практикуются при традиционной радиотерапии, и которые были проспективно протестированы в исследованиях II фазы. Кроме механической нестабильности, были проанализированы и другие прогностические факторы компрессионного перелома позвоночника. В частности, одновременное или предварительное введение бифосфоната во время перерывов в лечении длительностью минимум 6 месяцев может предотвратить возникновение компрессионного перелома позвоночника: использование профилактических инъекций золедроновой кислоты перед гипофракционной СЛТТ было испытано в ходе исследований I фазы, продемонстрировав 2% частоту возникновения компрессионного перелома позвоночника. Также было высказано предположение относительно возможного защитного эффекта избыточного веса и предварительного облучения.
Как представляется, помимо компрессионного перелома позвоночника режим СЛТТ не влияет ни на какие другие токсичности, но для подтверждения этой теории существует слишком мало данных из-за малого числа поздних осложнений. В частности, лучевая миелопатия встречается чрезвычайно редко и упоминается в менее 1% случаев в современной медицинской литературе. Интересно, что только максимальная доза (Dmax) на позвоночник или конский хвост позвоночника, соответствующая БЭД > 110 Гр, коррелировала с неврологическими нарушениями, независимо от дозы за одну фракцию. И наоборот, токсичность пищевода часто встречается после СЛТТ грудной клетки и может быть смертельно опасной хотя и для небольшой, но значимой части пациентов, в редких случаях приводя к смертельному исходу из-за массивного кровотечения или свища. Интересно, что были предложены многочисленные ограничения дозы, показывая значительные разногласия между авторами: например, предложенная максимальная доза Dmax, экстраполированная из клинических исследований, изучающих применение однофракционной СЛТТ для лечения пищевода, варьировалась от 15.4 и 22 Гр. Вполне вероятно, что другие переменные факторы, такие как движения органов , индивидуальная радиочувствительность, ранее проведенная химиотерапии и ятрогенные манипуляции могут влиять на частоту случаев токсичности пищевода.
СЛТТ позвоночника при олигометастатической болезни
Олигометастатические пациенты представляют собой подгруппу метастатических пациентов с низким бременем болезни (меньше или равным 3-5 метастазам) и потенциально подходят для таргетного лечения, чтобы получить контроль над макроскопическим участком болезни и теоретически продлить выживаемость. Недавнее проспективное когортное исследование, занимающееся метастатическими поражениями позвоночника, подтвердило значительное преимущество в выживаемости (+22% за 6 месяцев) у пациентов с олигометастатической болезнью против полиметастатического поражения (> 5 метастазов), независимо от методов лечения. СЛТТ широко применяется для лечения этого заболевания с целью получения максимального контроля над болезнью и облегчения симптомов. Во всех имеющихся случаях (таблица 1), авторы сообщают об отличных результатах локального контроля над спинальными метастазами у пациентов, прошедших лечение с помощью СЛТТ, а именно 62-67% пациентов имели стабильные сроки выживаемости длительностью 1 год без признаков системного прогрессирования с редкими случаями возникновения тяжелых неблагоприятных событий. Интересно, что лучший локальный контроль был отмечен у олигометастатических пациентов, получающих гипофракционную (от 3 до 5 фракций) СЛТТ спинальных метастазов по сравнению с полиметастатическими пациентами. Это можно объяснить проявлением фонового иммунного ответа по отношению к опухолевым клеткам или сдерживанием менее агрессивного фенотипа в олигометастазах. Таким образом, может сделать предположение, что дозовое фракционирование может участвовать в локальном эффекте СЛТТ через взаимодействие с синергией опухоль/носитель; однако, использование разнородных схем дозирования в этих ограниченных случаях не позволяют провести более глубокий анализ. Следовательно, нет никаких данных, касающихся оптимальных схем дозирования облучения для олигометастатических пациентов, хотя более длительная расчетная выживаемость подразумевает более жесткий компромисс между риском поздней токсичности и необходимостью устойчивого локального контроля. Для того, чтобы помочь врачам при выборе схем лечения, в настоящее существует множество прогностических инструментов, интегрирующих клинические переменные (PRISM, NOMS) в систему принятия решений.
Экстраспинальные костные метастазы
Общие положения
Использование СЛТТ для лечения неспинальных костных метастазов описано недостаточно последовательно. Во-первых, существует мало литературы, специально описывающей применение СЛТТ для лечения экстраспинальных заболеваний, поскольку большинство исследований сообщают только отдельные данные по лечению спинальных и неспинальных очагов болезни: однако, похоже, что эффективность лечения сравнима с 1-летним локальным контролем и уровнем контроля над болью 75-100% и 13-100% (таблица 1). Во-вторых, исследования, занимающиеся изучением экстраспинальной костной СЛТТ, часто включают в себя разнородную локализацию костей, а следовательно, на выбор суммарной дозы и схему фракционирования в разной степени могут влиять толерантность дозы соседних критических структур. Этим она отличается от спинальной СЛТТ, где лучевая миелопатия обычно считается основной токсичностью, ограничивающей дозу облучения.
Консенсусному определению целевого объема по-прежнему не хватает четкого разграничения экстраспинальных метастазов, в отличие от спинальной СЛТТ, по которой было принято совместное решение экспертной комиссии после выхода докладов о характере неудач лечения и интеграции МРТ. Насколько нам известно, лишь недавняя работа Ito et al исследовала характер неудач в 17 метастазах тазовых костей, получивших лечение гипофракционированием (30-35 Гр за 5 фракций) с облучением общего объема опухоли, очерченного с помощью МРТ, плюс дополнительные 5-10 мм до клинического объема опухоли, показывая 41% частоту возникновения рецидивов по краям области облучения / вне поля облучения, появляющихся в среднем на расстоянии 3.4 см (диапазон 1.5-5.5) от ближайшего края облучаемой опухоли: следовательно, расширение клинического объема мишени было поставлено под сомнение.
И наконец, неоднородность показателей, используемых в исследованиях, (облегчение симптомов или локальный контроль) может косвенно отражать использование различных критериев для отбора пациентов, в частности, в отношении принятия решения о направлении пациентов на СЛТТ, а не на традиционную фракционированную лучевую терапию. Например, СЛТТ облучение олигометастатических или олигопрогрессирующих несимптоматических метастазов может лежать в основе положительного тренда за счет включения подмножества пациентов, характеризующихся более благоприятным исходом лечения. Интересно, что только недавнее ретроспективное когортное исследование, проведенное Yu et al, определяло пациентов в соответствии с целью лечения: несмотря на очевидные различия в общей выживаемости, не было обнаружено никакой разницы в локальном контроле между олигометастатическими, олигопрогрессирующими и полиметастатическими пациентами, прошедших облучение доминирующей области прогрессирования болезни, показывая 1-летний уровень локального контроля 75.7%. Следует отметить, что уровень локального контроля различался в зависимости от критериев оценки ответа на лечение, что привело к 11.1% расхождению между критериями MDA (критерий ответа костей) и RECIST (критерии ответа солидных опухолей на лечение), и была найдена более конкретная корреляция между уровнем локального контроля по критериям MDA и лучшей выживаемостью.
Однофракционная или многофракционная SBRT костей?
Поскольку в большинстве исследований по экстраспинальной СЛТТ использовались различные схемы облучения, в современной медицинской литературе нет специальных статей по фракционированию доз в отношении контроля над опухолью, облегчения боли или ожидаемой токсичности. Интересно отметить, что использование однофракционной СЛТТ (15-24 Гр) в ретроспективных когортах колеблется от 1.8 до 52%.
Низкий уровень использования однфракционной СЛТТ в этих условиях может быть связан, в частности, с нежеланием врачей назначать однофракционную лучевую терапию пациентам с длительным сроком выживаемости из-за распространенного мнения, что однофракционная лучевая терапия приводит к повышенной токсичности, недостаточной эффективности лечения и необходимости повторного лечения. Однако, в настоящее время принято считать, что однофракционная лучевая терапии имеет такую же эффективность, как многофракционная традиционная лучевая терапия даже у пациентов с благоприятной ожидаемой выживаемостью. Кроме того, облучение мишени более высокими дозами может дополнительно улучшить терапевтический эффект однофракционной традиционной лучевой терапии. Наиболее интересен тот факт, что недавнее исследование II фазы, сравнивающее однофракционную СЛТТ терапию с многофракционной традиционной лучевой терапией, сообщало о значительно более высокие показателях контроля над болью как на ранних (2 недели), так и поздних (9 месяцев) контрольных сроках. Интересно, что по данным недавнего исследования из нашей группы, ни одна схема фракционирования СЛТТ не коррелировалась с контролем над болью, что было в большей части связано с особенностями самих пациентов, определяемых с использованием проверенных инструментов, таких как система классификации боли ECS-СР. Что касается токсичности, тяжелые неблагоприятные события, коррелирующие с облучением костей, включали переломы и обострение боли (определяемое как острый приступ боли или усиление боли, связанные с лучевой терапией). Сообщалось, что суммарная частота случаев обострения боли находилась в диапазоне от 10 до 68%, а однофракционная схема облучения и отсутствие предварительной стероидной терапии были основным прогностическими факторами. По нашему опыту, обострение боли случалось после 34% СЛТТ процедур, но ни один из переменных факторов не ассоциировался с этим событием.
Owen et al фиксировали обострение боли и переломы в 10% и 2% из 7 случаев со средней дозой 24 Гр за одну фракцию. Erler et al сообщали об общей частоте переломов 8.5%, что в значительной степени касается пациентов женского пола и литические метастазы: однако однофракционная СЛТТ составляла лишь 1.8% всех терапий.
Что касается вышеупомянутого проспективного исследования, не было обнаружено никаких различий в токсичности, в частности, перелома костей, имевших место у 1.2% пациентов в группе однофракционной SBRT.
Заключение
Стереотаксическая лучевая терапия тела (СЛТТ) зарекомендовала себя как безопасный и эффективный метод лечения метастатических заболеваний костей, обеспечивающий быстрое облегчение боли и превосходный контроль над заболеванием с приемлемой токсичностью. Ее применение варьируется от дооперационного лечения болезненных метастазов до повторного облучения областей в непосредственной близости от органов, ограничивающих дозы облучения. Она также помогает продлить период ремиссии у олигометастатических пациентов. Несмотря на большое количество литературы, нельзя сделать окончательный вывод о превосходстве одного метода над другим: в частности, неясно, имеет ли многофракционная схема облучения лучшее терапевтическое соотношение между контролем над заболеванием и риском возникновения неблагоприятным событий по сравнению с однофракционной СЛТТ.
Хотя клиническая эффективность при лечении спинальных метастазов обнаруживается уже при дозах 12-16 Гр одной фракцией, была отмечена зависимость доза-ответ, что может говорить в пользу однофракционного облучения (в частности, при радиорезистентных гистотипах), возможно путем теоретического использования альтернативных радиобиологических эффектов, связанных с сосудистым апоптозом и возникающих при дозах > 10-15 Гр / фракция. Однако, применение доз ≥ 20 Гр за одну фракцию может увеличивать риск серьезных побочных эффектов, таких как компрессионный перелом позвоночника, в частности, у пациентов с рисками высокой степени (увеличенный литический компонент, смещение позвонков, старые переломы): необходимо соблюдать осторожность при использовании однофракционных схем облучения, которые могут представлять интерес для пациентов с низкими баллами нестабильности позвоночника (SINS) и / или в комбинации с вертебропластикой.
И наоборот, миелопатия встречается нечасто, но она может иметь место при высоких суммарных дозах (БЭД> 110 Гр) независимо от схемы фракционирования. По экстраспинальной костной СЛТТ есть мало данных, но недавнее проспективное исследование дает основание полагать, что, несмотря на относительное редкое использование, однофракционная СЛТТ может не сопровождаться более высокими показателями токсичности, и она продемонстрировала потенциальное преимущество над многофракционной традидционной лучевой терапией в плане облегчения боли. Множественные рандомизированные исследований (NCT02608866; NCT03028337) в настоящее время сравнивают однофракционную СЛТТ с многофракционной терапией.
Оригинал статьи можно прочитать здесь